研究内容
マイクロメートルサイズの微粒子である,微小液滴,マイクロカプセル,無機微粒子,ポリマーラテックスは,記録材料,化粧品,食品,溶媒抽出,固相抽出,クロマトグラフィー,土壌等に関係しており,その化学的・物理的特徴を理解することは基礎・応用にわたって重要である。従来は,たくさんの微粒子の平均値測定から微粒子界面や内部で起こる化学反応,吸着,物質移動等が研究されてきた。しかしながら,微粒子・微小液滴が小さくなると比表面積が大きくなるため界面の寄与が増加し,また,物質移動,界面物性等,大きな粒子と異なった挙動を示すことから,単一微粒子・微小液滴ごとにサイズの関数として研究することが必要不可欠である。
当研究室では,マイクロメートルサイズの微粒子・微小液滴の界面・内部で起こる物理・化学プロセスを,顕微鏡下で単一微粒子ごとにレーザー光またはマイクロキャピラリーで捕捉・操作し,単一微粒子の電気化学・分光計測(下図参照)で解析,反応制御することを目的として研究を行っている。
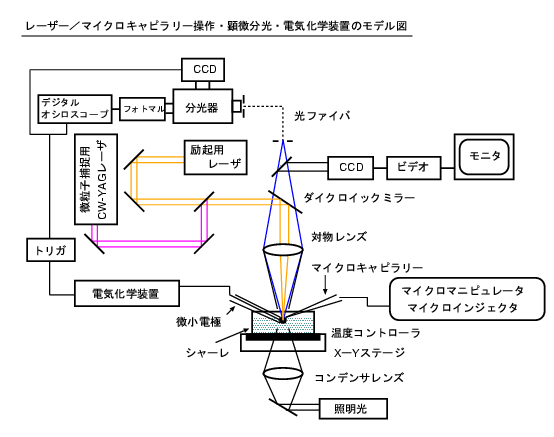



(左)…顕微鏡前面
(中)…微粒子トラップ用 10W CW Nd:YAGレーザーと光学系
(右)…トリガ・分光器・デジタルオシロ・フォトマル・CCD・電気化学装置・ガス圧式マイクロインジェクタなど
微粒子系における化学・物理プロセスの研究(中谷教授)
 単一微粒子を溶液中にインジェクションし,溶質が多孔性粒子のメソ細孔内で吸脱着,物質移動する過程を単一微粒子の分光計測から
反応速度論的に研究を行っている。細孔内における溶質のポア拡散,表面拡散,泳動,細孔出入り口における
物質移動過程について検討している。
単一微粒子を溶液中にインジェクションし,溶質が多孔性粒子のメソ細孔内で吸脱着,物質移動する過程を単一微粒子の分光計測から
反応速度論的に研究を行っている。細孔内における溶質のポア拡散,表面拡散,泳動,細孔出入り口における
物質移動過程について検討している。
汚染土壌の浄化(中谷教授)
米中のカドミウム濃度の基準値が2011年より0.4 mg/kgに改正され,水田土壌からのカドミウム除去の早急な対策が求められている。 当研究室では,水田土壌からカドミウムを溶出させ,浄化用鉄粉でカドミウムを除去する研究をCORDAと行っている。 実験室で土壌分析,除去実験をするだけでなく,現地での調査と実証試験も行い, 土壌浄化によって玄米中のCd濃度を0.4 mg/kg未満にする技術開発を検討している。ヘモグロビンの協同効果発現機構の解明(長友講師)
ヒト成人ヘモグロビン(Hb A)はヒトの赤血球中に存在し,肺から細胞へ酸素を運搬する機能をもつ.この機能は,酸素結合に伴いHb Aの酸素親和性が変わるHb Aの協同効果による.Hb Aはα鎖とβ鎖のそれぞれの鎖2つずつからなり,活性部位にヘムをもつ分子量65000のヘムタンパク質である(下図参照).1959年のPerutzによるX線結晶構造解析で原子レベルでの解析が可能となって以来,今日まで機能と構造に関する数多くの研究があり,原子レベルで多くのことが分かっている.その中でも,deoxy(脱酸素)形,oxy(酸素結合)形のX線結晶構造(それぞれT, R構造と呼ぶ)に基づいてPerutzが提唱した「酸素結合,脱着に伴う四次構造変化(T ≒ R)がHbの機能発現(協同効果)にとって重要」というPerutz機構1)が広く知られている.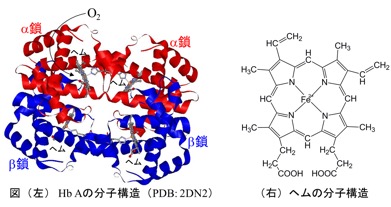
しかしながら,Perutz機構では説明のつかない事例が近年報告されている.協同効果に影響をもたらすBPG(ビスホスホグリセリン酸),BZF(ベザフィブラート)などの共存下では協同性が事実上消失するが,このような環境下でも酸素結合に伴うTからRへの四次構造変化が起こっている2).この結果に対し,米谷らは「四次構造変化」に依らない協同効果発現機構(Global allostery機構)として,分子動力学計算からヘム近傍の主鎖であるE-, F-ヘリックスのゆらぎの振幅が協同効果に寄与すると主張している2)-4)が,今のところ実験的には明らかにされていない.
上に示した四次構造変化,主鎖のゆらぎに基づいて協同効果を明らかにしようとする研究の一方で,そもそも「Hbのα鎖とβ鎖は協同効果の発現にどのような役割を果たしているのか.」ということについても,筆者の知る限り,明確な答えはないように思われる.α鎖とβ鎖が区別されないで解析されることもあるが,α鎖とβ鎖ではアミノ酸残基数も141と146で異なり,相同性も46% ( 146 - 79 ) / 146で高くない.また,四量体のHb A(α2β2)を単離鎖に分けたα鎖(二量体との平衡),β鎖(四量体との平衡)では,いずれの場合も協同効果を発現しない5).このことは,協同効果の発現にはヘテロ四量体α2β2をとることが必須であることを示している.この謎を解くべく研究を進めている6).
(参考文献)
1) Perutz, M. F. (1970) Stereochemistry of cooperative effects in haemoglobin. Nature 228, 726-739
2) Yonetani, T., Park, S. I., Tsuneshige, A., Imai, K., Kanaori, K. (2002) Global Allostery Model of Hemoglobin. Modulation of O2 affinity, cooperativity, and Bohr effect by heterotropic allosteric effectors. J. Biol. Chem, 277, 34508-34520.
3) Yonetani, T., Laberge, M. (2008) Protein dynamics explain the allosteric behaviors of hemoglobin. Biochim. Biophys. Acta 1784, 1146-1158.
4) Yonetani, T., Kanaori, K. (2013) How does hemoglobin generate such diverse functionality of physiological relevance. Biochim. Biophys. Acta 1834, 1873-1884.
5) Tyuma, I. Shimizu, K. Imai, K. (1971) Effect of 2,3-diphosphoglycerate on the cooperativity in oxygen binding of human adult hemoglobin. Biochem. Biophys. Res. Commun. 43, 423-428.
6) Nagatomo, S., Nagai, Y., Aki, Y., Sakurai, H., Imai, K., Mizusawa, N., Ogura, T., Kitagawa, T., Nagai, M. (2015) An Origin of Cooperative Oxygen Binding of Human Adult Hemoglobin: Different Roles of the α and β Subunits in the α2β2 Tetramer. PLoS ONE 10, e0135080.
超音波を利用した単一粒子に基づく微量計測(宮川助教)
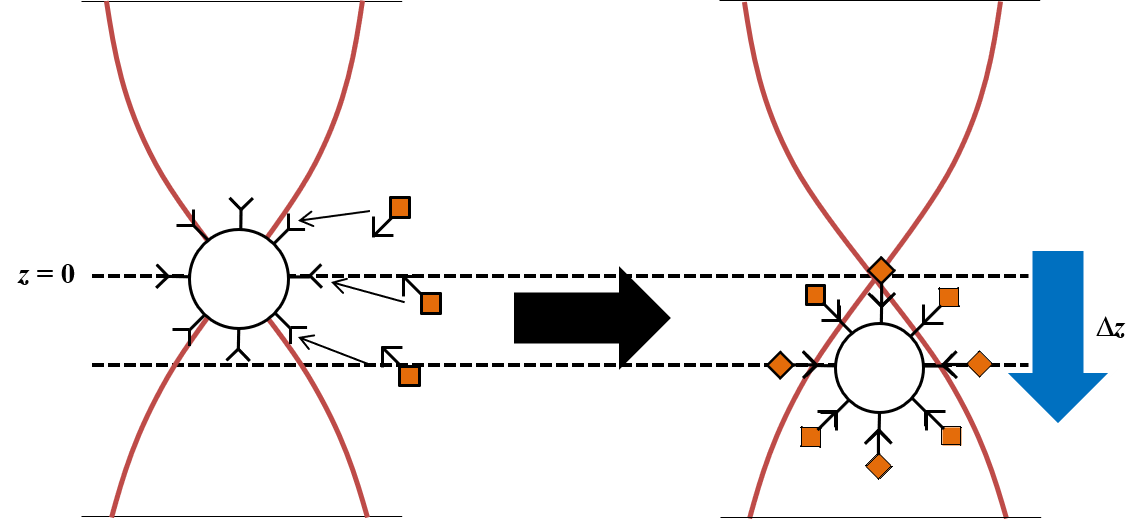
超音波定在波中に粒子を導入するとを鉛直方向に発生させると、粒子には下記の音響放射力(Fac)という力が働く。この力は粒径、密度、圧縮率の関数であり、一般的な粒子は定在波の節に集まる。超音波定在波を鉛直方向に発生させると、重力との複合場が形成される。このとき、粒子の浮揚位置は次の式で与えられる。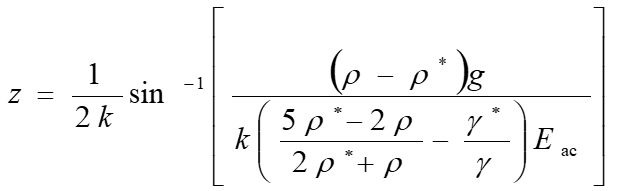
この式は、音響物性(密度・圧縮率)の異なる粒子を異なる位置に浮揚させることを意味している。また、反応を介して、マイクロ粒子の密度変化を誘起することができれば、マイクロ粒子の浮揚位置が変わることがわかる。これまでに、マイクロ粒子と金ナノ粒子の結合反応を浮揚位置の変化として計測することで、zmol(10-21mol)オーダーで検出できることがわかった。
この検出原理に基づき、アビジン-ビオチン反応、DNA/RNA、生理活性物質の検出をおこなった。このほかにも、超音波放射力を利用した様々な原理に基づく微量計測法を考案し、理論の実証を行っている。
宮川助教の最近の研究はこちら
